医療安全を考えるとき、医療機器をめぐる法制度や取扱い方法、製品改良の手続きなどが現場関係者のフラストレーションを募らせることが多い。その解消のため、行政やメーカー側も動き出している。2013年11月23日にビッグサイトTFTホールで開かれた「第8回医療の質・安全学会学術総会」シンポジウム2では、医療機器に関わる4人の専門家がそれぞれの立場で報告をした。同テーマで催した第7回のシンポの継続企画でもある。
安全対策に狙い定めた改正薬事法案
「薬事法改正について」
藤田倫寛(厚生労働省医薬食品局 審査管理課 医療機器審査管理室)
医療機器は人や動物の病気やけがの治療、予防、診断の目的で使用されるもので、身体の機能に影響を与えるものと定義され、診断に使うものと治療に使うものとに大別される。日本は診断用が強く、治療用はほとんど輸入に頼っている。その隔たりは、何千億円もの輸入超過状態にある。医療機器が現場に届くまでには、治験も含めた開発、承認審査、我々とPMDA(独立行政法人医薬品医療機器総合機構)の審査を経る。
医療機器は人体に与えるリスクに応じて4つに分類される。一番リスクの低いクラスⅠは「一般医療機器」と呼ばれ、届出だけで医療現場に届けられる。クラスⅡは「管理医療機器」とされ、ほとんどが第三者認証となる。
上位のクラスⅢとⅣは「高度管理医療機器」に分類される。人体へのリスクが高いため、大臣承認が必要。ただ、実際の審査は厚生労働省ではなく、PMDAで行われる。企業の申請に基づいてPMDAが科学的な審査をし、最終的に厚労大臣が認証するという仕組みだ。
これまでになかった革新的な医療機器は「新医療機器」としてPMDAで審査される。ほとんど同一性が認められるものは「後発医療機器」、新と後発の中間は「改良医療機器」と分類される。新医療機器は製造販売後も医療現場での使い方のデータを取って検証する。
術者の腕に左右される医療機器
医療機器審査管理室では、ニーズの高い医療機器で「海外で使われているのに日本では使われていないもの」を学会や患者団体などから声をあげていただく「医療ニーズの高い医療機器等の早期導入に関する検討会」を年2~3回行っている。専門の医師に集まっていただき、本当に現場に導入する意義があるのか検討し、日本国内に導入していただくべく行政の立場から企業にお願いする取り組みだ。その結果、人工心臓の大部分(4種類)や頚動脈のステント、小児用や難病用の治療機器を日本に導入できた。
薬事法はもともと、医薬品を基にした法律なので、医療機器と薬の間で制度上のひずみが長年蓄積している。医療機器はうまい術者が使えば安全で有効だが、そうでないと安全性と有効性のバランスを崩す。飲めば、ある程度の効果が得られる薬に対して、医療機器は術者に左右されるということだ。だから、薬を主体とした法律ではうまく回らないという声は現場からもあがっている。
このため、どういう資格と経験を持つ医師が、どんな設備であれば安全、有効に使えるかというガイドライン作りを学会レベルで進めている。具体的には、関連学会の医師に集まってもらい「この手術なら10年程度の経験で安全だろう」などとあらかじめ示してもらうことで審査が短縮できる。使う側にガイドラインを示してもらうことで差し支えないとするのも新しい取り組みといえよう。いわゆる「デバイスラグ」解消への道筋でもある。
実情に即した制度への取り組み強める
11月20日に参議院を通過した薬事法改正案では、安全対策の強化を大きな柱としている。具体的には、添付文書を現場が理解して使えるような仕組みで、アップデートも早くして届出制とする。医療機器の特性に合った制度改正も大きな柱だ。医療機器は医薬品と違い、改良、改善を重ねるたびに安全性も有効性も向上するからだ。特に、インプラントやコンタクトなどクラスⅢのものに審査基準を設け、第三者機関で認証できるようにしてPMDAの負担を減らすようにしている。
販売後の新しい医療機器にも再評価、再審査する機関を設けていたが、それを少し柔軟にした。見るべきものは見て、見なくてもいいものは見ないという仕組みに流れが変わってきている。これまで薬事法の規制対象になっていなかったプログラムやソフトウエアに関しても見直す動きがある。
医療機器の安全性を見る薬事法は大きく変わろうとしている。このため、業界や医師との話し合いを持ちながら実情に即した制度にしていく取り組みが始まっている。
患者第一の共同チームでありたい
「後工程は患者さん~消費者として、サービス提供者としての医療者~」
安田あゆ子(名古屋大学医学部附属病院医療の質・安全管理部)
2012年9月に「内視鏡手術の術後レントゲンに異物らしきものが写っている」のが発見された。内視鏡手術に使う「トロックスガーゼ」の糸の切れ端だった。「Five-whys」分析によると、X線造影糸が遺残したのは手術操作の途中で端が切れたから⇒(たぶん)鉗子で端をつかんだから⇒切れやすい素材だから⇒そこがつかみやすいから⇒形状的に飛び出しているから、ということが分かった。
使っている4診療科に「飛び出した糸は必要か」と聞くと、すべての診療科がいらないと答えた。そこで、メーカーに対応を要請したら、名古屋大学病院仕様を作るとの回答を得た。とても良い対応でありがたかったが、私は「うちの病院がヘタだからという話ではなく、このガーゼを使う人にとって問題じゃないか」ということを言いたかった。
その後、メーカー側の問題であったコスト面が解決できたので、端にX線造影糸が出ていない(ガーゼ内側に端が縫いこまれている)ものに改定し、全国に出荷するという連絡が入った。
医療者とメーカーで異なる現状把握の考え方
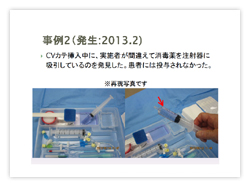
2013年2月には「CVカテ挿入中に、実施者が間違えて消毒薬を注射器に吸引している」のを別の人が発見した。例によって「なぜなぜ」をすると、消毒液が投与されかけたのは注射器に吸われたから⇒生理食塩水と消毒薬の区別がつきにくいから⇒双方の色が見分けにくいから⇒トレイが半透明だから⇒作業スペースとして使用するコンプレッセンが青色だから、ということが分かった。
発見者は「自分は消毒後に消毒トレイは戻さないようにしているが、急いでいるとつい間違える」と話していた。昔はイソジンを使っていたので色で間違えることはなかったが、今は薄紫色のクロルヘキシジンが第一選択なので、こういうことが起こると思った。結果的にメーカーに対応していただき、従来のものよりも白っぽいものに改変された。
この事例では、認知的負担や身体的負担を減らすことをメーカー側で対応していただくことで再発防止につながったと思う。医療者とメーカーとでは現状把握の方法が違うのではないか。私たちはインシデント報告ベースでテーマを設定する。その決め手は「しょっちゅう起こっている」という現場の声だ。
それに対してメーカーでは品質管理の中で見えるばらつきの中で何が問題かを考えているのではないかと思った。こういうことはどれくらい起きているのかとメーカーから聞かれることがあるが、数字に表せない部分がある。しかし、メーカーでは有害事象かどうかということが現状把握の優先事項になっている面がある。そこに齟齬があるのではないかと考えている。
医療者とメーカーが平場で話し合える環境を
医療者として、さまざまな事例を経験して分かったのは、エラー再発防止に資する改善策が、医療機関内では完結できないことだ。とはいえ、メーカーとの間で問題意識を共有することは必ずしも容易ではない。背景には、医療者とメーカーとの歴史的関係がある。この点は改善が必要だろう。だから、平場で話し合う環境が大切だ。
その上で、メーカー側には、たとえ有害事象になっていなくても、単なるクレーム処理ではなく、改善に対する現場の真摯な意見として対応してほしい。改善方法についても「添付文書に付け加えた」では不十分。記載しさえすれば責任は現場に移ると考えてもいただきたくない。
安全管理部に収集されているニアミス事例や不具合事例はメーカーも有効活用できるはずだ。根本的に教育が不足しているなら、研修の機会を設けるなどの対策も講じるのも一法。医療者とメーカーとの共同を進めるには、PMDAのような機関が、有害事象以外にも対応できる組織になってほしいと思う。
医療安全管理室への働きかけが重要
「医療現場と医療機器メーカーの意識の違いを埋めるための取り組みについて」
三田哲也(日本医療機器産業連合会PMS委員会)
日本医療機器産業連合会は、医療機器をめぐる諸課題について、薬事法や改良改善などの規制問題、医療現場に対する意見などを収集し、改善していく企業団体だ。その活動の一つに医療機器の添付文書を分かりやすく医療現場に伝えるための取り組みがある。添付文書や改訂案内が臨床現場に届いていなかったり、時間がなくて読まれていなかったりする現状を踏まえたものだ。
そこで、予測予防に対する新たな取り組みとして、近畿大学病院で病棟の指導者を対象に安全対策研修(T-PAS研修)を行った。会場ではグループごとに注射器を壊してもらった。病棟で壊すことは絶対にないが、プラスチックだから壊れることはある。そして、この体験を病棟にどう持ち帰るかという話をしてもらった。有名な「ラーニングピラミッド」によると、学習定着率は講義を聞いただけでは5%だが、他人に教えると90%に跳ね上がる。参加者はリスクマネージャーなので、その実効力には意味がある。メーカーはこういう地道な取り組みも行っている。
色を変えるだけで8カ月もかかる仕組み
改良事例では、安田先生からご指摘のあったCVカテーテルキットに対する取り組みをメーカーの立場から報告したい。最初に安田先生からお話があったとき、非常に危険だと思った。どこでも起こり得ると判断した。薬事法上、改良改善は面倒な申請が必要ないのですぐに取りかかった。たかが色の変更とはいえ、材料確保に2週間ほどかかった。幸い、トレイの製造メーカーに白いシートの在庫があったから2週間で済んだが、なかったら、安全性や安定性の確認などで2カ月くらいかかる。
その後材料を手配して試作するが、製品として大丈夫かを検証する必要がある。たかがトレイといっても安全性とか機能とか耐久性とかを確認しなければならないからだ。社内では変更に伴って製造作業者が手順を間違えないように体制を変えなければならない。社内回覧などの周知徹底作業に1カ月。そして、生産し納品するまでに1カ月半。こうした作業を積み重ねると色を変えるだけでも8カ月あまりかかる。半ばメーカーとしての言い訳だが、社内ではいろいろと手を打っているということはご理解いただきたい。
関係者から高い評価得た共同のお願い文書
今回の報告テーマである「競争の中の協力」の事例として、アンチフリーフロー機能付き輸液ポンプに対する動きを紹介したい。このポンプの普及を阻害する要因は「輸液セットの高コストと、ポンプとセットが製品固定の組み合わせでの使用となること」であった。行政も開発、普及を企業に通知していると謳っているが「検討すること」という結語のため、医療機関側のインパクトは弱かった。
そこで2013年7月に厚生労働省を訪れ、通知の追加発行を要望した。この結果、企業間連名などの手段で同種ポンプを市場にアナウンスする了解を得た。同時に、お知らせ文書を出す目的や経過を看護協会や臨床工学士会、使用している医療機関などにアナウンスする旨の進め方に賛同を得た。
紆余曲折はあったが、結果的にお知らせ文書(案)について当局やPMDAに確認を求めたところ、11月12日に了解された。今後は企業名連名による能動的な安全性情報提供物として医療機関へ配布していく。
今回のお知らせ文書は幸い、医療機関の医療安全に携わっている多くの先生方から高い評価を得ている。しかし、メーカーの考える価値観と必ずしも同じとは言えないのではないかという懸念もある。重要なことは、医療現場や医療従事者の方々が何を欲しているかという情報収集を的確に行っていくことではないか。その意味でも、最前線と位置づけられる医療安全管理室への積極的な働きかけが重要であると思う。
「やるかやらないか」が大きな問題
「医療機器のライフサイクルを重視した法制度の必要性について」
飯田隆太郎(日本医療機器産業連合会法制委員会)
医療現場の方は理解しにくいかもしれないが、医療機器のライフサイクルは常にベッドサイドから生まれる。医工連携、医工共同でものが作られる。市場提供した後に発生するのが使用者からのさまざまな意見や要望だ。そういう流れの中で改良改善しながらサイクルを回していく。だから、開発して出荷したらおしまいではなく、このサイクル全体を回していくのが医療機器のライフサイクルといえる。
そこで、このライフサイクルを包括するシステムを我々医療機器業界では「クオリティマネジメントシステム」と言っている。その思想は「患者の利益が中心にある」ことだ。そのため、市場に出した製品については改良改善のための声を絶えず聞き、技術革新につなげる。マイナスの意見についてもきちんと監視して設計に反映させていく。そういう活動を通じて社会貢献を実現させるのが医療機器のマネジメントシステムだ。
99%の製品が審査されない米国の実態
ところが、一旦承認された医療機器を変更するたびに再審査する制度を持っているのは先進諸国では日本だけ。規制する対象物を特定し、その「物」と取り扱い業者を取り締まるという不動の思想が薬事法の根底にある。つまり、化学物質と工業製品を同一の思想で規制し「物質の構造や組成」と「機器の使用」を同様の概念で特定するという考え方だ。だから、一旦「特定」されたものがかわることは重大な変更とみなされる。どこかが変わればそれをすべて審査するという発想はいかがなものか。
参考までに、米国の場合、医療機器は工業技術製品だから画期的革新は非常に少ない。新製品は常に前の技術を踏襲しているということで、99%の製品が審査されず、3カ月くらいで市場に出ていく。費用は大企業が48万円、中小企業が24万円くらい。日本は150万~240万円で、時間も手間もかかる。これも大変な負担になっている。
周知のように、医療機器は医療行為と一体化した道具なので、先生の力量に左右される。つまり、リスク/ベネフィットが画一的でないため、ヒューマンファクターの介在を無視し得ないという特性がある。その上で、医療機器特有のリスク/ベネフィットに臨床現場の現実的な感覚を含めた審査や規制思想を導入していかないと医療機器の改良改善はなかなか進まないという実態がある。
技術改良を阻害しない法制度を
新しい安全な技術を開発、普及させていくためには製品を提供する企業側の努力研鑽だけでなく、より安全な社会の実現に向けた、利害を超えた協調が必要だ。普及、振興に向けた社会全体の取り組みも重要になる。こうした技術改良を阻害しない法制度の整備も欠かせない。そのためには、新しい製品や技術を厳しく規制するだけの萎縮方向ではなく、技術改良を支援し、より新しい技術を推奨し、普及させる制度であることが望ましい。
そして、新しい安全な技術を社会が積極的に評価し、その価値を一般に周知し、その技術によって得られる利益を皆が支障なく共有できる社会の実現を目指すべきだろう。
医療機器産業は自動車産業と大きく異なり、多種多様な製品を取り扱うことから「多品種少量生産」という産業特性を持つ。そのため企業規模も一般に小さく、研究開発に他学の投資を行うことは困難な事情もある。しかし、医療機器を使用する医療機関の方々を含め、官民が相互に知恵を出し合いながら、利害得失を超えた協力関係の中で、真に患者さんのためになる「医療の質と安全の向上」を目指すべきではないか。
こういうことを言うと、できないんじゃないかと言われるが、問題は「できるかできないか」ではなく「やるかやらないか」であることを強く提言したい。
取材:伊藤公一