日本医療器材工業会 常務理事 山本章博氏
前回のこのコーナーで、いろいろなメーカーの製品の「組み合わせ」のところで起きる事故が多いという話を聞いた。メーカー側が医療機関での使用状況をチェックすることの必要性も指摘された。そこで、今回は日本医療器材工業会の常務理事である山本章博氏に、医療機器の安全対策についてお聞きした。(取材日;平成17年7月21日)

最初に貴工業会を簡単にご紹介下さい。
日本医療器材工業会は(1)輸液・輸血セット、(2)注射筒・針、(3)カテーテル(汎用及び血管系)、(4)ダイアライザー及び血漿交換関連製品、(5)整形インプラント製品、(6)人工血管など体内埋め込み製品、(7)人工心肺など、(8)在宅酸素・CAPD等在宅医療関連製品、などの製造や輸入販売に係わっている企業の団体です。医療機器を扱っている工業団体20団体で日本医療機器産業連合会を構成しておりますが、それら全売上の約半分を占めている最大の団体です。
貴工業会における医療機器の安全対策についての考え方を教えて下さい。
従来、安全対策というのは「各企業が個々の医療機関を訪問して、製品に関する苦情や問題点を教えていただいた上で、製品の改良や安全対策を実施する」 いわば、企業の営業活動の一環として行われていました。従って、それらの情報は各企業の秘密情報として他の企業には明かされないというのが一般的でした。ところが、最近は医療の安全対策に関心が高まったことや個々の医療機関向けに企業が安全対策を施したことが結果的に医療機器の機能や規格などを複雑にしてしまい、逆に医療事故を起こしてしまうケースも多数でてきました。安全対策は企業単独の活動よりも、工業会として全体で取り組まないと解決できないということになってきました。 従って、現在、私達の工業会では医療の安全対策は工業会活動の最重要課題と位置付けております。
貴工業会で取り組んできた活動を紹介して下さい。
事故防止に対する日本医療器材工業会としての取り組み
単独企業の安全対策ではなく、工業会として取り上げたものは以下の通りです。
- 輸液ラインと栄養ラインの誤接続防止対策
- ジャクソンリースと気管切開チューブの誤接続防止対策
- 輸液ポンプ・シリンジポンプの安全対策
- 透析回路のロック式接続
- 塩化ビニル・可塑剤対策
代表的なものを幾つかご紹介下さい。
輸液ラインと栄養ラインの誤接続防止対策について紹介します。これは本来、栄養ラインに投与されるべき薬剤が、間違って輸液ラインに投与されてしまったために、患者が死亡してしまった事件に端を発して、スタートしたプロジェクトです。原因は輸液ラインも栄養ラインも接続は同一のサイズ規格を採用していたために誤接続してしまったのですが、これに対して、私達は約15社でWGを形成して検討を重ねた結果、栄養ラインとして輸液ラインとは物理的に接合しないサイズの規格を作ることにしました。これは世界に先駆けて制定された安全対策であり、欧米でも、同様な事件は発生しているにもかかわらず、現在でも、彼らは統一的な安全対策を決定していません。私たちは日本の基準を国際標準にするために働きかけをしているところです。
その他、塩化ビニル・可塑剤対策についてですが、可塑剤(DEHP)に影響を受けるといわれる乳幼児や妊産婦に使用される栄養ラインについては医療機関に対して代替品の使用を推奨し、各企業は代替品の開発に全力をあげることとしました。これも欧米に先駆けた内容で、小児科領域の医師などから高い評価をいただいております。
安全対策を施した製品を広めるために努力されていることは?
医療事故対策適合品マークについてご紹介します。
当工業会では、厚生労働省によって新たに安全性基準が設定された医療機器について、医療事故防止対策品であることを医療機関において容易に確認できるよう、業界自主基準として適合品マークの表示をすることを決めました。マーク貼付については、公正性や透明性を高めるために、外部の専門家(医師、臨床工学技士や看護師等)を含む「適合品マーク評価委員会」で判定しています。
適合品マークを貼付できないと判断された企業は、新たに改良を加えて申請し直していただいています。ちなみに輸液ポンプに関する2004年3月の審査結果は次のとおりでした(図表1参照)。
図表1. 新安全基準通知後厚生労働省から承認取得した16製品を「適合品マーク評価委員会」で判定した結果
| 医療事故対策適合品マーク(右図)の貼付 |  |
|
|---|---|---|
| 可 | 8品目 | |
| 条件付可 | 4品目 | |
| 不可 | 4品目 | |
適合品マークを取得した製品については日本医療器材工業会のHP(http://www.jmed.jp)に掲載されております。
なお、適合品マークの医療機関における認知度等を平成14年度に調査しました。認知している施設は残念ながら3割ほどに留まりましたが、認知している施設では6割以上の施設で安全対策に有効であると評価していただきました。現在、さまざまな機会を捉えて、適合品マークの認知度向上に努めているところです。ご協力をお願いいたします。
6月に厚労省から出された「今後の医療安全対策について」の中で、医療機器に関する【当面取り組むべき課題】としては、医療機器の管理に関する責任体制の整備、医療機器の保守・点検と使用に関する研修の実施、医療機器メーカー等による有害事象の情報収集・共有・提供体制の整備、といったものが挙げられています。これらに対して具体的にはどのような取り組みがなされている、あるいは今後必要でしょうか。
工業会が当面取り組むべき課題
1)医療機関からの情報収集、提供体制の整備
今まで、特に有害事象に関する情報の入手或いは適正使用に関する情報提供などが医療機器企業において十分ではなかったという指摘はあります。本年四月から施行された薬事法改正でも強く、求められていることでもありますので、工業会としても周知徹底しているところです。また、情報提供の手段の一つとして添付文書の内容の整備及びDB化も進めています。
2) 機能、規格の統一化の推進
同一の医療機器であっても、機能や規格が違うために、医療事故やヒヤリ・ハットに結びついたという指摘は多く、寄せられています。個々の医療機関からのご要望に個々の企業が対応したために、新しい機能が次々と付加されたことも一因と考えられております。医療機関の要望が多岐に亘ることから、企業側だけで勝手に統一することはできません。解決が容易ではありませんが、現在、新しい基準作りやJIS化の作業を進めていますので、統一化の方向で全力をあげたいと考えます。
3)医師会、看護協会、臨床工学技士会等との連携
安全対策の推進には他団体との連携が非常に重要であると考えます。現在、日本看護協会や日本臨床工学技士会とはいろいろな場面で連携が進みつつあります。以前、安全器材開発プロジェクトでは日本医師会と私達の工業会と連携して活動しましたが、私達の活動を理解していただくための貴重な機会でした。ぜひ、今後も連携して、活動できればすばらしいことであると考えます。
では、課題達成のために医療機関へのアドバイスをお願いします。
医療機関への要望
1)医療機器専門窓口の設定
医薬品の場合、薬局が医療機関の専門窓口となっております。企業は薬局という窓口へいろいろな情報を持っていきます。行政からの通知も薬局が窓口になり、医療機関の内部へ伝えます。しかし、医療機器の場合、専用の窓口がないために、企業は情報をどこに持っていくのが良いのか困っております。医療機関の現場に医療機器の新基準などが伝わらないのも、専用の窓口がないのが一因ではないかと考えます。最近の医療機器は高機能で取り扱いも煩雑になっています。窓口設置に当たっては、工学的な知識を持った臨床工学技士を適正に配置し、医療機関内への情報伝達、教育などの体制を築いていただけるとありがたいと考えます。
2)保守点検の確実な実施
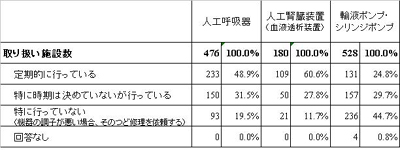
厚生労働省が収集しているヒヤリ・ハット事例を見ると、医療機器の定期点検や使用前点検をしなかったために発生したと思われる事例が毎回、多数報告されています。残念ながら、医療機器の保守点検があまり行われていないようです。東京都が都内の病院で実施したアンケートで、輸液ポンプ・シリンジポンプの保守点検実施頻度を見ると、定期的に行っているのは24.8%という結果でした(図表2参照)。定期点検を行わないと、どんなに良い機器でも使えなくなってしまう可能性があります。
自動車でも、基本的には、買った方が自発的に定期点検に出す、日常的には自分で点検し、どうしてもダメなときにメーカーに出す、というようになっていると思います。医療機関でも、できれば臨床工学技士のような方が中心になって、点検を行っていただきたいと思います。企業と医療機関が契約を結んで定期的に点検してもらうこともひとつの方法でしょう。それでも、最低限、使用前点検は医療機関で行っていただかなければなりません。
3)添付文書の活用
2年前(平成15年)から医療機器にも添付文書の記載が義務付けられました。添付文書および取扱説明書には点検や部品交換、装置の清掃など必要事項はすべて記載することになっていますが、医療機関からは「こんなにたくさん、とても全部読めない」という声が多いのが現状です。しかし、添付文書の中で「警告」「禁忌・禁止」の欄は、最も重要な項目ですので、是非読んでいただきたい。
従来、同一の製品でありながら企業によって使用上の注意などの記載箇所がまちまちであるということがありました。これについては、業界全体で統一する方向で是正することになっています。そして、実際に使用する臨床現場で見やすいものに改めるように検討しています。医療機関側でも、記載内容について気付いた点があれば、企業に指摘していただきたいと思います。より良い添付文書となるように双方で協力していければ安全対策に大いに役立つものと期待しております。
医療機器は医薬品に比べて種類が多いにもかかわらず、医療機関内にその専門窓口が整備されていない。それゆえに企業は、個々に寄せられてくる希望に合わせたものを作成し、統一性に欠ける製品が出回っているということがわかった。医療機関側にとっては、医療機器に関する情報の収集・伝達の専用窓口を設けることが最も急がれる課題ではないだろうか。それがすぐには無理であれば、まずは医療機器の添付文書にある「警告」「禁忌・禁止」欄に確実に目を通すこと、ここから実行していただきたい。