近年、わが国の成長戦略の一つとして再生医療が注目されている。再生医療の考え方は昔からあるが、それを一層推し進める契機となったのは2012年の京都大学iPS細胞研究所・山中伸弥教授のノーベル賞受賞であろう。しかし、再生医療に対する注目の高さとは裏腹に、厚生労働省から承認され、臨床現場で実際に使われているわが国の「再生医療等製品」は現在、自家培養表皮『ジェイス』と自家培養軟骨『ジャック』の二つだけである。その両方を手がけたのが愛知県蒲郡市に本拠を置く株式会社ジャパン・ティッシュ・エンジニアリング(略称J-TEC)だ。小澤洋介社長に第一号製品『ジェイス』の開発に取り組むことになった経緯や、同製品をめぐる安全面での考え方などを聞いた。

切手大の皮膚組織を3週間で畳大に
『ジェイス』はヒト細胞を組み込んだ再生医療製品の国産第一号。患者の正常な皮膚から表皮細胞を取り出して増やすことから「自家培養表皮」と呼ばれる。フラスコの中で培養した細胞シートは、重いやけどを負った患者に対する表皮移植の際に用いられる。
『ジェイス』の有効面積は1枚あたり80平方センチメートル。これは日本人の平均体表面積(1万6000平方センチメートル)の0.5%ほどにあたる。J-TECは治療を行う医療機関と密に連絡を取りながら、やけどの大きさに応じて必要な枚数を培養する。
自家培養表皮を使う利点は移植に伴う拒絶反応を起こさないことだ。たとえ正常な表皮であっても、他人のものを移植することはできない。その点、自分の細胞を増やしてつくる『ジェイス』なら無理なくなじむ。
培養表皮のシートを大量に培養する基本的な技術を開発したのは米ハーバード大学のハワード・グリーン教授である。1970年代のことだ。この培養技術を使うと、患者から採取した切手大の皮膚組織を3週間で畳大に増やすことができる。グリーン教授はこの技術に基づく製品化を「一カ国一企業」に限って認めている。無論、日本で製品化できるのはJ-TECしかない。「国内バイオベンチャーの中で、工場を保有しているのは当社だけ」と、小澤社長は胸を張る。
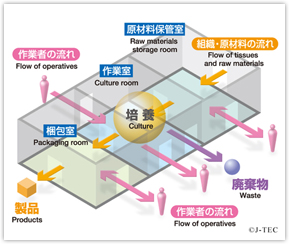
皮膚組織という「生きた素材」を扱うことから、採取から治療に至る過程における安全性を保つための丹念な検査や厳しい品質管理などは抜かりない。
開発を始めてから10年後に上市
時計の針を少し戻そう。1990年代、諸外国ではすでに、複数の会社が再生医療の事業化を目指してしのぎを削っていた。しかし、日本ではまだ誰も手がけていない状態。それどころか、一般には再生医療という言葉すら知られていなかった。そんな時代に、今日の再生医療に着目したのが小澤社長の実父で眼科医療機器メーカー、(株)ニデックの創業者でもある小澤秀雄氏であった。
「将来のビジネスのネタになる新規事業を考える社内組織『21世紀委員会プロジェクト』が中心となってリサーチした膨大な候補の一つが再生医療でした。そこで、論議の末に選んだのが、日本ではまだ誰も手がけていなかった組織工学(ティッシュ・エンジニアリング)だったのです」(小澤社長)。こうしてJ-TECは当初、親会社の新規事業として、99年に設立された。
米国で最初に上市された再生医療等製品は前述のグリーン教授が開発した「グリーン型培養表皮」と呼ばれる自家培養表皮である。適応疾患は重症熱傷だ。こうした流れを踏まえ、J-TECも自家培養表皮からの幅広い製品化を計画した。その過程で、当時の厚生省とも協議を重ねた。
その結果「自家培養表皮は他の皮膚疾患への適応も想定されるが、未知のリスクも否定できないため、リスク&ベネフィットの観点から、当社もまずベネフィットの大きい重症熱傷患者への適応から着手することになりました」(同)。こうして、同社は重症熱傷に特化した自家培養表皮開発に向けて大きく舵を切る。
当時は再生医療等製品の治験を始める前に確認申請(2011年6月に廃止)に適合する必要があった。加えて、同社製品による治験症例数が2例しかないことが妨げとなり、製造販売承認の取得や保険適用の協議に想定以上の時間を要した。「結局、上市できたのは開発を始めてから10年後の2009年でした」(同)。
「生きた素材」扱うことの難しさ
『ジェイス』の事業化で予想外だったのは保険適用に関する留意事項として「算定限度(枚数制限)」と「施設基準」が課せられたことであったと小澤社長は振り返る。
「事業初年度は、なんと総出荷枚数の60%を無償で病院に提供する結果になりました。無償提供の是非は取締役会でも幾度となく議題にあがり、そのたびに激しく意見を交わしました。事業からの撤退を真剣に検討したこともあります。どんなに有意義な事業であっても、肝心な会社が持たなくては元も子もありません」。しかし、J-TECは踏ん張った。
その後、算定限度と施設基準は2年ごとの診療報酬改定時に緩和され、直近の2013年度には出荷枚数の90%以上を有償で提供することができた。
「生きた素材」を扱うことの難しさを小澤社長が痛感させられるのは自家培養表皮の増殖に要する時間と、それを必要とする患者に残された時間との戦いであるという。それは『ジェイス』が患者自身の細胞で患者を治療することを目的とする完全オーダーメイド製品であることの宿命でもある。
「ジェイスが使えるのは『深達性Ⅱ度+Ⅲ度≧30%』です。平たくいえば、体表部分の30%以上をやけどしている重い患者さんに限られている。ジェイスはオーダーメイド製品であるため、作製には3週間必要です。しかし、この間に、それを必要とする方が亡くなられる事例も多く発生します。患者様が亡くなられるなどの理由で製造を中止すると、その費用はすべて当社が負担します。その割合は受注の三分の一にも及びます。このことが、重篤な疾患を対象とした自家培養製品の特異性といえるのです」(同)。
全症例に対する使用成績調査を実施
『ジェイス』は個々の患者の状況に合わせたオーダーメイド製品であると同時に、救命への寄与を求められている製品でもある。重症熱傷の患者群の術後死亡率は50%を超えるとされるだけに、その存在意義は重い。
培養の対象年齢も広い。小澤社長によると、その範囲は生後2カ月の新生児から99歳の成人にまで及ぶという。ただし、原料となる細胞の「活き」は患者によって大きく異なる。当然、若いほど活きがよく、年を重ねるにつれて鈍くなる。
「当社はメーカーとして、すべての注文に対して、必要な枚数分を3週間で作製することを約束しています。もちろん、単に製品を届けるばかりでなく、その工程における管理には厳しい体制で臨んでいます。例えば、品質を担保するために、各製造ロットの出荷検査を半日かけて検査しています。安全な製品をお届けするのはもちろんですが、ジェイスは再審査期間(7年間)が終了するまで全症例に対する使用成績調査を実施することが承認の条件になってもいます」(同)。
使用期限56時間を支える物流体制
全症例に対する使用成績調査の義務付けは一種の医療安全対策に他ならない。『ジェイス』は生きた細胞を利用する製品であるため、使用期限56時間という使用が設定されている。そこで、同社はどんなに悪天候であっても56時間以内に保存温度10~25℃で日本全国の医療現場に届ける物流体制を整えている。決め手になるのは輸送の段取りや受け入れ準備など、分秒を争う場面における医療機関との綿密な連携であろう。
「過去には、ジェイスを作製したものの、製品が出荷規格を満たしていなかったため、出荷を断念したことがあります。医療機関と細心の連携を図ったにもかかわらず救命に寄与できなかった事例もありました」。小澤社長は『ジェイス』という製品に関わることの厳しい現実を打ち明ける。
「それだけに、自家培養製品の出荷基準設定の妥当性や、メーカーとしての企業倫理のあり方など、多方面にわたる深い議論が必要だと思います」。
この他にも(1)作製に関わる作業者は配属後1年経たないと患者の細胞を扱うことができない(2)出荷時には患者一人当たり20項目にも及ぶ検査を8時間かけて行う――など、品質管理のための厳しい決まりが定められている。
厳しい品質管理で安全を確保
このように、同社は原材料の受け入れから製品出荷までの工程を通した品質管理を厳しく行っている。再生医療等製品の有効性、安全性は人の生命に大きく関わるために極めて高品質な製品の製造が求められるからだ。
このため、同社は医薬品・医療機器の製造基準であるGMP・QMS基準に準拠し、清浄空調設備や空圧管理システムによる環境管理、人、モノの動線管理などでクリーンな環境を高水準に保っている。
こうした環境下で高品質で安定した製品を提供するため、製造ラインでは細胞培養について十分訓練を受けた作業者が標準操作手順書に従って製造している。
原材料の管理では、品質確保の観点から製造に使用する原材料の製造元を厳しく選び、受け入れ規格に適合したものだけを用いる。動物由来の原材料については、感染症に対するリスクを配慮し、厚労省の示す生物由来原料規準を遵守し、安全性が確保されたものだけを使っている。
製造環境の管理では、製品を清浄な環境下で製造するために、定期的な清掃を徹底。浮遊微粒子数や環境微生物などのモニタリングに力を入れている。
自らの姿勢が安全性を担保する
国内で唯一、再生医療等製品を商用生産できるQMS適合施設を整えている同社は、いわゆる医工連携の面でも先駆者的な存在である。「それだけに、自らがきちんとした製品をつくり上げることが安全性の担保にもつながると思うのです」と小澤社長は強調する。
「目指しているのは再生医療の産業化。これまで日本に存在しなかった再生医療という新しい産業を創り上げることに真剣に取り組んでいるのです。日本には、20年以上も前から、再生医療に関わる革新的な科学技術があります。これを製品として医療現場に投入し、普及させるためには企業の参画が必須です。このため、当社は製品化、事業化の先にある産業化に照準を合わせています」。
産業化を推し進めるためには、旧来の医工連携ばかりでなく、再生医療の発展に適した法規制の見直しや制定が必要だ。この他にも、日本の医療保険制度のあり方や特殊材料の安定調達、物流網の確立など、多方面にわたるプレイヤーの連携が求められる。産業界が中心となって国民の世論形成を行うことは再生医療の将来を見据えた大切な取り組みとなるはずだ。
プロフィール
小澤洋介(おざわ・ようすけ)氏略歴
1986年早稲田大学理工学部工業経営学科卒業。88年同大学院理工学研究科機械工学専攻修了。(財)SRIインターナショナル入所。95年イリノイ大学経営修士修了、MBA取得。96年(株)ニデック入社。2004年(株)ジャパン・ティッシュ・エンジニアリング社長。1964年、愛知県生まれ。
連絡先:株式会社ジャパン・ティッシュ・エンジニアリング
愛知県蒲郡市三谷北通6-209-1
TEL:0533-66-2020
FAX:0533-66-2019
URL:http://www.jpte.co.jp